327
328
こんなことは少し考えれば分かること。私がいつも不思議に思うのは、立派な肩書きを持った方たちが厚労省の分科会に出席していていろいろ議論しているにもかかわらず、誰一人として立ち上がって「このmRNA型生物製剤は本来危険なものでワクチンに使用すべきでない」と言わないこと。これが大きな疑問。
329
幸か不幸か、mRNA型生物製剤には免疫抑制効果があって、接種したほとんどの方が死ぬ事態を免れた。とはいうもののリスクが極めて高いものであることは明らかです。それに加えて抗原のスパイクタンパク質に毒性があるという強力なおまけ付きでした。これも大きな問題です。問題だらけの生物製剤!
330
今回のmRNA型生物製剤はヒトの免疫機構に真っ向から挑戦するようなものです。最初から薬害がおきることは当然のもの!つまりうまく免疫できると次の接種の時にスパイクタンパク質を発現した細胞が自らの免疫機構によって攻撃されることが必然の仕組みです。この反応が激しくおきれば死んでしまう。
331
このことが明らかになると誰も接種しなくなる。そのために強力な情報統制が必要だったと考えるべきでしょう。ここにAlzhackerさんのブログの記事を貼り付けておきます。情報統制がなぜ必要であったのか、それは、こちらを読めばわかるでしょう。
alzhacker.com/trusted-news-i…
332
個体差、それが運命の分かれ道になっているのだと思います。何らかの理由で免疫抑制がうまく機能しなかった方は重篤な副作用に苦しむというもの、これはヒトに接種すべきものではないと思います。このmRNA型生物製剤が重大な薬害を引き起こすことはわかる人には初めから分かっていたのでは?
333
mRNA型生物製剤がいかに大きなリスクを伴うものかが理解できたのではと思います。本来であるならば、接種者がバタバタ死んでもおかしくないものですが、死亡者が増えていないのは、幸か不幸か、今回のmRNA型生物製剤に免疫抑制をするしくみが備わっていたからです。免疫抑制には個体差があるのでしょう
334
335
これは細胞傷害性T細胞(キラーT細胞)によって行われます。細胞性免疫が確立するということは、ウイルス由来のタンパク質を合成している細胞を殺傷できるT細胞の準備ができたということです。この反応がどのようなタイミングでおきるのかについて考えてみましょう。
336
その中に見慣れないものが混じっていればそれが感染細胞だとなるわけです。このように免疫システムは細胞内でどのようなタンパク質を合成しているかを絶えず細胞外に提示させる仕組みを進化の過程で獲得し、もしも外来のタンパク質を産生している細胞があれば、それを殺傷する仕組みを持っています。
337
ウイルス感染細胞かどうかを識別するには、細胞内で生産しているタンパク質を全て細胞膜上に提示すればいいとなったわけです。その中に見慣れないものが混じっていればそれが感染細胞だとなるわけです。このように免疫システムは細胞内でどのようなタンパク質を合成しているかを絶えず細胞外に提示する
338
ウイルスを構成するパーツで重要なものはタンパク質。そのため、ウイルスは感染した細胞でウイルスの部品であるタンパク質を合成できないと増殖できない。つまりウイルスが感染した細胞ではウイルスのタンパク質が生産される。この性質を利用して感染細胞を検出するわけです。
339
なぜこのような作業を細胞が行っているのか。このような仕組みが存在することのメリットはなにか。それはウイルスとの戦いに打ち勝つためです。ウイルスというのは自力でタンパク質を合成する能力を有していません。そのため、細胞に感染することによって宿主細胞内の蛋白合成のしくみを利用します。
341
342
mRNAを取り込んだ細胞が攻撃されるしくみはこれだけではありません。もう一つの細胞攻撃部隊も出動するのです。今回使用されているmRNA型生物製剤の最大の問題点は生体にとって異物であるスパイクタンパク質を細胞内で産生して免疫している点です。このことも薬害発生の重要な原因となります
343
345
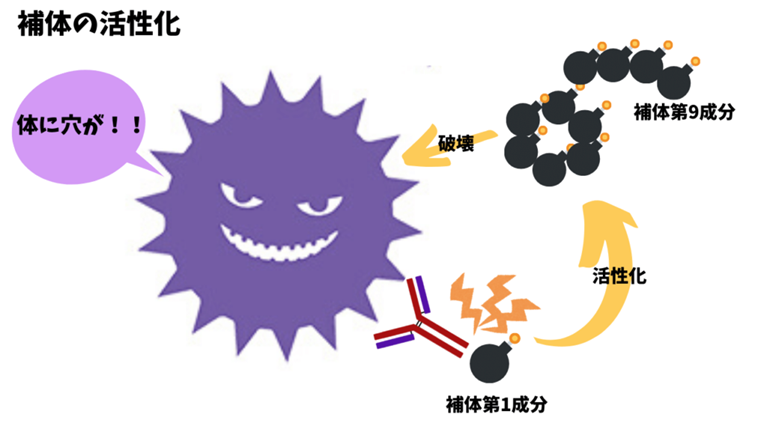
その結果、膜侵襲複合体(MAC)が形成され、標的細胞が溶解することになる。補体系は、ヒトのIgG1、IgG3、IgM抗体によって効率的に活性化され、IgG2抗体では弱く、IgG4抗体では活性化されない」
補体は細菌や細胞に抗体が結合したものを見つけると活性化されて細胞や細菌に穴を開けて殺してしまいます
346
これはWikiからの引用。「補体依存性細胞傷害、英: complement-dependent cytotoxicity、CDC)は、IgG抗体およびIgM抗体のエフェクター機能である。抗体が標的細胞(細菌やウイルスに感染した細胞など)の表面抗原に結合すると、これらの抗体に結合したタンパク質C1qによって補体系の古典経路が作動。
347
抗体が結合した細胞が攻撃されるしくみはもうひとつあります。それは補体(complement)によるもの。補体というのは血液中に存在するタンパク質の一つです。補体による細菌や細胞の殺傷メカニズムは、抗体や細胞性免疫といった獲得免疫ができる以前に確立したと考えられています。
348
NK細胞(ナチュラルキラー細胞)による攻撃がおきるタイミングですが、接種する前に感染したことのある人では初回接種からおきるでしょう。最初の接種だけでも一ヶ月後にはIgG抗体が誘導されていますので、二回目の接種では多くの人におきるでしょう。ブースター接種では全員でおきることになります。
350
新型コロナウイルスの表面にスパイクが並ぶのと同様に細胞の表面にスパイクタンパク質が林立することになります。スパイクタンパク質に対する抗体が存在する状態でmRNA型生物製剤を投与すると細胞表面のスパイクに抗体が結合します。その先はどうなるか、ADCCと呼ばれる現象が体中でおきることになる。